订购电邮:order@theta-gene.com
技术支持:support@theta-gene.com
拓展基因编辑工具箱:细菌毒素DarT2带来"附加编辑"新范式
基因编辑领域迎来了一项突破性技术。在最近发表于Nature Biotechnology的研究中,科学家们开发了一种名为"附加编辑"(append editing)的全新基因编辑方法,通过将化学基团附加到DNA上而非直接改变碱基,实现了与传统碱基编辑器截然不同的编辑效果。
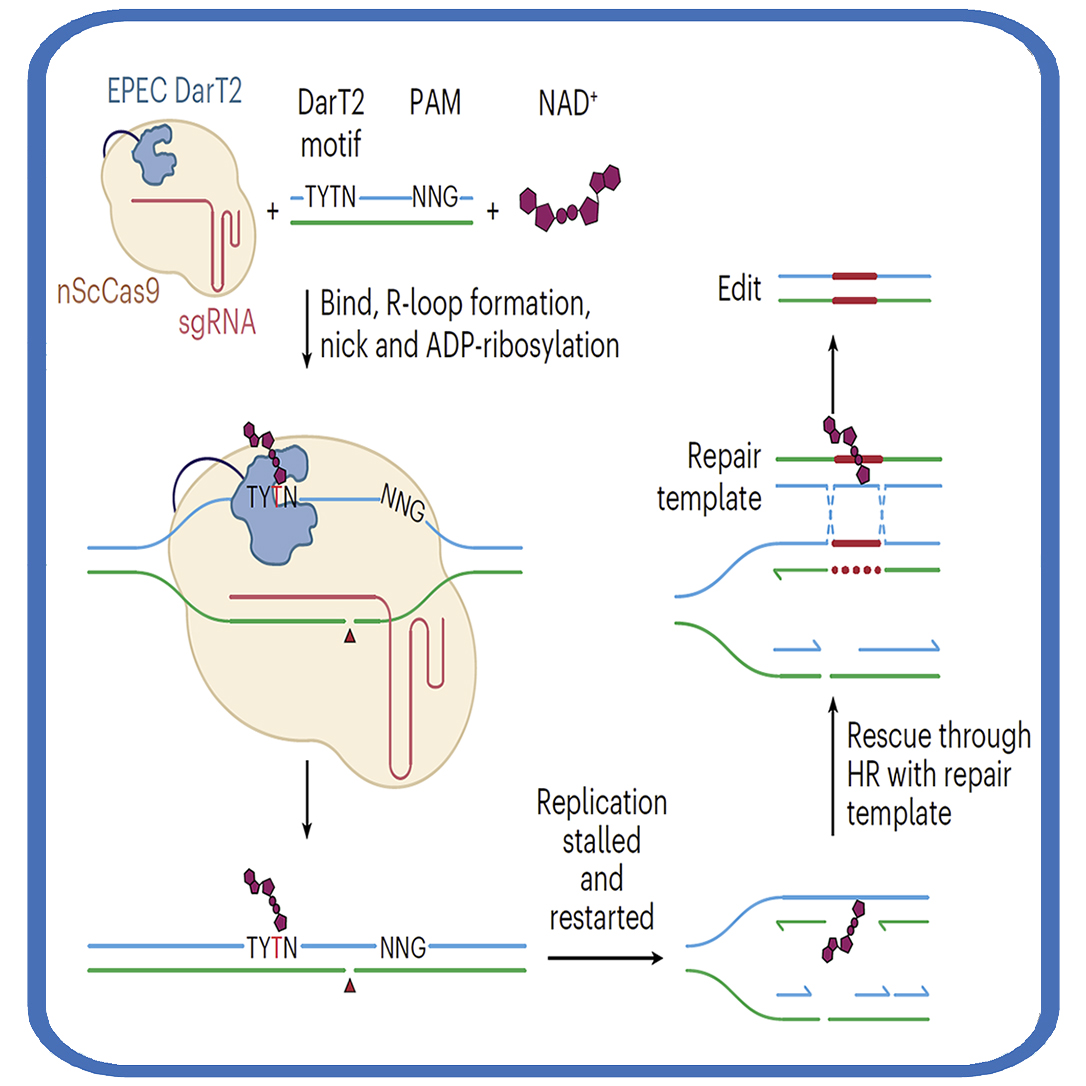
创新性:从"减法"到"加法"的编辑思维转变
传统碱基编辑器依赖于脱氨酶或糖基化酶来移除碱基上的化学基团(如氨基或整个碱基),属于"减法"编辑策略。而这项研究独辟蹊径,采用"加法"策略——将ADP-核糖(ADPr)化学基团附加到DNA碱基上。
研究团队从细菌抗病毒毒素DarT2中获得灵感。这种毒素通常被细菌用来对抗噬菌体感染,它能够将ADPr基团附加到DNA胸腺嘧啶的N3位置上。通过将减毒版本的DarT2与CRISPR-Cas9系统融合,研究人员创造了能够进行位点特异性ADP-核糖基化的编辑工具。
重要发现:生物界线的编辑差异
研究发现,附加编辑在不同生物中产生了截然不同的结果:
在细菌中:主要驱动同源重组,实现了灵活、无疤痕的基因组编辑,无需碱基替换或反选择。编辑效率高达97%,且不会导致明显的碱基突变。
在真核生物中(酵母、植物和人类细胞):主要引起碱基突变,修饰的胸腺嘧啶被替换为腺嘌呤或胞嘧啶混合物,插入缺失极少。这种T-to-A或T-to-C的编辑模式是现有碱基编辑器无法实现的。
特别值得注意的是,人类细胞中的TARG1蛋白能够逆转ADPr修饰,因此只有在TARG1缺失或抑制的情况下才能观察到有效的编辑效果。
技术优势:精准且多样化的编辑能力
与传统CRISPR-Cas9系统相比,附加编辑表现出多项优势:
高特异性:几乎不产生sgRNA无关的脱靶效应
低indel率:比Cas9低6-110倍的小插入缺失频率
大片段编辑:在细菌中可实现长达91bp的替换、插入和删除
独特编辑模式:主要产生T-to-A和T-to-C变异,填补了现有编辑器的空白
应用前景:从基础研究到临床治疗
附加编辑技术的潜在应用价值巨大:
遗传病治疗:能够逆转789种已确认的致病性单核苷酸变异(涉及355个基因),这些变异使用现有的胸腺嘧啶碱基编辑器无法解决。特别是对于ATM基因中导致共济失调毛细血管扩张症的特定突变,附加编辑能够在不影响相邻胸腺嘧啶的情况下进行精准修复。
细菌基因组工程:为非模式细菌的多重编辑和大规模染色体文库构建提供了强大工具,优于传统的prime编辑和CRISPR相关转座子系统。
DNA修复机制研究:为研究局部与全基因组DNA修复提供了新工具,有助于理解不同类型DNA加合物如何驱动突变和致癌过程。
未来展望
研究人员指出,除了DarT2对胸腺嘧啶的ADP-核糖基化外,还有许多其他碱基修饰酶领域有待探索。例如,DarT1毒素和真核生物的pierisin毒素能够对鸟嘌呤进行ADP-核糖基化,而细菌和噬菌体使用多种独特化学基团(如甲基氨基甲酰基、dPreQ等)修饰其DNA。
这项研究不仅拓展了基因编辑的工具箱,更重要的是展示了一种全新的编辑范式——通过"添加"而非"移除"化学基团来实现精准基因组编辑。随着进一步优化和发展,附加编辑有望成为基因治疗、合成生物学和基础研究领域的强大工具。
这项技术的真正威力在于其多样性——同一平台在不同生物体中产生截然不同的编辑结果,这为理解和发展针对特定应用的定制化编辑策略提供了丰富的机会。












